Dr. Fine-Beaute
製造・品質管理等の安全性基準及び手順書
―目次-
1. 目的
2. 製造販売の流れ
3. 製造管理・品質管理業務の体制及び責任者の役割
4. 製品企画・設計
5. 製造管理
6. 入荷・保管・出荷管理/品質管理手順
7. 品質等に関する情報及び品質不良等の処理に関する手順
8. 原因究明等の手順
9. 回収処理に関する手順
10. 自己点検に関する手順
11. 情報収集の手順
12. 教育訓練に関する手順
13. 文書及び記録の管理に関する手順
1. 目的
セリスタ株式会社(以下、セリスタ)は、医療機関向けに高品質なオリジナルサプリメントを提供し、最終的に一般消費者の健康増進に貢献することを目指しています。この目的を達成するため、製品の設計から製造、保管、発送に至るまでの全工程において、厳格な「サプリメント製造および品質管理等の安全性基準」を策定いたします。本基準は、セリスタが既に長年にわたり運用してきた医療機器製造・販売業並びに化粧品製造・販売業のGQP(Good Quality Practice)及びGVP(Good Vigilance Practice)に準拠する高い品質と安全性を確保し、医療機関および患者様に安心してご使用いただける製品を提供することを目的としています。
2. 製造販売の流れ
サプリメントの製造において、製品の企画・設計・原材料選定は医師監修の元でセリスタが行い、製造は外部のGMP(Good Manufacturing Practice)認定工場に委託します。製造した製品はセリスタで保管し、受注の都度各医療機関(病院・診療所・歯科医院・薬局など)へ発送します。セリスタから直接一般消費者への販売は一切行いません。

3. 製造管理・品質管理業務の体制及び責任者の役割
(1)製造管理・品質管理業務に係る組織及び職員
代表取締役は製造管理・品質管理業務を適正かつ円滑に遂行するため、次の責任者を設置するとともに、必要な人員を確保します。
①製造・品質管理業務を適正かつ円滑に遂行しうる能力を有する総括責任者を設置します。
②製造管理業務を適正かつ円滑に遂行しうる能力を有する製造管理責任者を設置します。
③品質管理業務を適正かつ円滑に遂行しうる能力を有する品質管理責任者を設置します。
④製造管理・品質管理業務を適正かつ円滑に遂行されているか、監査役を設置し定期的に監を行います。
⑤製造・品質管理業務の体制は、下記【体制図】のとおりとします。

(2)代表取締役の遵守事項及び業務
①関連する法令に従い適正に製造販売が行われるよう必要な配慮をします。
②製造販売しようとする製品の品質管理を適正に行います。
③総括責任者、製造管理責任者及び品質管理責任者がそれぞれ相互に連携協力し、その業務を行うことができるよう必要な配慮をします。
④総括責任者が責務を果たすために必要な配慮をします。
⑤総括責任者の意見を尊重します。
⑥総括責任者に以下の(3)に掲げる業務を適正に行わせます。
⑦製造責任者に、製造管理業務手順書に基づき、以下の(4)に掲げる業務を適正に行わせます。
⑧品質責任者に、品質管理業務手順書に基づき、以下の(5)に掲げる業務を適正に行わせます。
⑨品質管理業務手順書を承認、配布及び保存(改訂の履歴を含む)します。
⑩品質管理業務手順書に基づき作成した記録を適正に保存します。
⑪品質標準書を承認、配布及び保存(改訂の履歴を含む)します。
⑫製造業者等との取決めを行います。
(3)総括責任者の遵守事項及び業務
①品質管理及び製造販売後、安全管理に係る業務に関する法令及び実務に精通し、公正かつ適正に業務を行います。
②品質管理業務を公正かつ適正に行うために必要があると認めるときは、代表取締役に対し文書により必要な意見を述べ、その写しを保存します。
③製造管理責任者と品質管理責任者との相互の密接な連携を図ります。
④品質管理責任者を監督します。
⑤品質管理責任者からの報告等に基づき、所要の措置を決定し、その実施を品質管理責任者その他品質管理業務に関係する業務の責任者に指示します。
⑥品質管理責任者の意見を尊重します。
⑦製造管理責任者と品質管理責任者その他の品質管理業務に関係する業務の責任者との密接な連携を図らせます。
(4)製造管理責任者の業務
製造管理責任者は、以下の4及び5で定める「製品企画・設計/製造管理」に基づき、次に掲げる業務を行います。
① 製造管理業務を統括します。
② 製造管理業務が適正かつ円滑に行われていることを確認します。
③ 製造管理業務の遂行のために必要があると認めるときは、総括責任者に文書により報告します。
④ 製造管理業務の実施にあたり、必要に応じ、製造業者等、その他関係する者に対し文書による連絡又は指示を行います。
(5)品質管理責任者の業務
品質管理責任者は、以下の6で定める「入荷・保管・出荷管理/品質管理手順」に基づき、次に掲げる業務を行います。
① 品質管理業務を統括します。
② 品質管理業務が適正かつ円滑に行われていることを確認します。
③ 品質管理業務の遂行のために必要があると認めるときは、総括責任者に文書により報告します。
④ 品質管理業務の実施にあたり、必要に応じ、製造業者等、その他関係する者に対し文書による連絡又は指示を行います。
(6)監査担当の業務
監査担当は、本安全性基準に基づき、製品の設計・製造・品質管理が適正に行われているかを確認し、必要に応じ、他関係する者に対し指示を行います。
4. 製品企画・設計
(1)製品設計
①企画主旨:目的や市場ニーズを明確化した上で設計を行います。
②医師監修:特に安全性、禁忌(医薬品との相互作用、特定の疾患など)について医師の監修を受けながら設計します。
③情報収集:文献検索や医師からの情報収集により、各栄養成分の推奨適正摂取量、耐容上限量、過剰症などを確認した上で設計します。
(2)原材料の選定
①吸収率や安全性を考慮した原料を選定します。
②医薬品に該当する成分は採用しません。
③不明な原材料については事前に厚生労働省健康安全部薬務課監視指導担当(03-5320-4512)に問い合わせします。

5. 製造管理
(1)製造業務は信頼と実績のある外部のGMP認定工場へ委託します。
(2)製品設計書と原材料選定書に基づいた製品の製造管理
①工場視察:GMP認定工場を視察し衛生環境の適切性、製造工程などを確認します。
②原材料の選定
・原材料の安全性の確保:事前にメーカーからの情報収集、文献検索、各種毒性試験を実施します。
・製造工程管理(GMP)による安全性の確保:全工程における製造管理・品質管理や原材料の純度と品質の確認及びアレルゲンや有害金属などの汚染物質のチェックを行います。
・製品規格書、安全データシート、原料製造所認証書(GMP)などを製造業者へ請求し保管します。
③試作品の製造・確認(予備試験の実施)します。
④加速度試験を実施し、適正な消味期限を設定します。
⑤栄養分析、汚染物質検査を実施します。
⑥包装:容量に適した包材・サイズを選定します。
⑦ラベル:消費者に必要な情報を全て視認性を保持して明記します。
【記載項目】
・商品名 ・名称 ・原材料名 ・内容量 ・賞味期限 保存方法 ・販売者
・製造固有記号 ・お問合せ先 ・お召し上がり方 ・注意事項 ・栄養成分表示
・「食生活は、主食、主菜、副菜を基本に、食事のバランスを。」
・定められた文字サイズを厳守し消費者の視認性を確保します。
⑧工場から出荷する際は商品の破損や汚れに注意し梱包・出荷します。
(3)製品標準書
品質管理責任者は、品目ごとに製品の品質に係る必要な事項を記載した文書(以下「品質標準書」という)を作成し保管します。
当社が製造する際は、製品標準書には以下の事項を記載します。
① 商品名
② 使用方法及び使用上の注意事項
③ 製造所の名称、所在地
④ 原料成分の名称、規格及び配合量
⑤ 容器、包装形態及び表示内容
⑥ 保管条件及び取扱い上の注意事項
⑦ 製品規格及び試験検査方法
⑧ 出荷基準
⑨ 製造業者等との取決め内容
⑩ その他必要事項
⑪ 制定者、制定年月日
⑫ 改訂年月日、改訂事項、改訂理由及び改訂者
6. 入荷・保管・出荷管理/品質管理手順
(1)品質管理責任者は製造工場から製品が入荷した際に下記事項を確認します。
①外箱・数量・外観・ラベル
②実際に開封し製品の色、匂い、破損などの異常の有無
③ロットごとに5個の参考品を所定の位置に賞味期限まで保管
④入庫記録の記載(ロット番号・日付・数量・残数)及び保管
⑤「市場への出荷に係る記録」に記録
⑥商品の品質に問題があった場合は直ちに製造元へ連絡し、原因を究明すると共にその製品が市場に出回らないように注意
(2)保管場所と保管上の注意
①常に整理整頓清潔が維持された所定の場所に保管します。
②直射日光が当たらない場所に保管します。
③気温が30℃を超えない通気性の良い場所に保管します。
④直接床に置かず、所定の清潔な棚に整理整頓して保管します。
⑤製造ロットを混同せず、先入れ先出しを厳守します。

(3)出荷管理
①商品の出荷時は品質管理の最終チェックポイントのため重要な作業と心得えます。
②医療機関から受注した際は、品目・注文数を確認し各種伝票を作成します。
③商品の払出:注文数量を払い出し、在庫残数を確認します。
④商品の外観、ラベルや中身の状態に異常は無いか確認します。
⑤在庫管理表に「日付」、出荷先「施設名」、数量をロットごとに入力し、理論在庫と実在庫に差異が無いかを確認することで、トレーサビリティー対策とします。
⑥出荷先医療機関には販売先を当該患者の自費診療カルテへの記載を6カ月ごとにメールにて促し、トレーサビリティー対策とします。
⑦商品が破損しないよう十分配慮して梱包します。
⑧夏場(7月1日~8月末)は高温による品質劣化を防ぐため「冷蔵宅配便」で出荷します。気温の状況に応じて期間を前倒しまたは延長します。

7. 品質等に関する情報及び品質不良等の処理に関する手順
(1)総括責任者は、製造販売するサプリメント等に係る品質等に関する情報(苦情を含む)を得たときは、「品質情報・品質不良などの処理記録」に記録します。
(2)総括責任者は、上記(1)の情報に基づき、品質不良又はそのおそれがあると評価した場合には、代表取締役に口頭並びに「品質情報・品質不良などの処理記録」により速やかに報告します。
(3)総括責任者は、人の健康に与える影響を評価し、下記の「8.原因究明等の手順」により、原因を究明し、品質不良等に関する調査を行い、「品質情報・品質不良などの処理記録」に記録します。また、代表取締役に速やかに報告します。
(4)総括責任者は、上記(2)、(3)の報告により、品質不良又はそのおそれが判明した場合には、危害発生防止等のため、速やかに回収・販売中止等の所要の措置を決定し、品質管理責任者及びその他関係する業務の責任者に指示し、その内容を「品質情報・品質不良などの処理記録」に記録します。
(5)品質管理責任者は、上記(4)の指示に基づき速やかに所要の措置を講じ、その結果を総括製造販売責任者に「品質情報・品質不良などの処理記録」により報告します。
なお、回収を行う場合は、「9.回収処理に関する手順」に従うこととします。
8. 原因究明等の手順
(1)総括責任者は、原因の究明にあたり、当該医療機関の医師に速やかに相談し情報収集を行うと共に、同時に製造販売業における品質管理業務について調査し、その結果を「品質情報・品質不良などの処理記録」に記録します。調査の結果、改善が必要な場合は所要の措置を講じ、代表取締役に「品質情報・品質不良などの処理記録」により速やかに報告します。
(2)総括責任者は、原因の究明にあたり、製造所に起因するものでないことが明らかな場合を除き、速やかに製造業者等に対して、メール及び電話で調査を依頼し、その内容を記録します。製造業者等による調査結果は文書により報告させ、その結果を「品質情報・品質不良などの処理記録」に記録します。調査の結果、製造業者の製造管理及び品質管理に問題があった場合は、該当製品の品質不良又はそのおそれの及ぶ範囲を決定し、その影響を受ける該当製品のロットを特定します。
(3)総括責任者は、上記(2)の調査の結果、製造業者の改善が必要と判断した場合は、「品質情報・品質不良などの処理記録」に記録し、改善を指示します。
(4)総括責任者は、製造業者に対して改善結果の報告を文書で求め、その報告を適正に評価し、必要に応じてその製造所の改善状況について実地にて確認します。
(5)総括責任者は、上記(4)の結果を「品質情報・品質不良などの処理記録」に記録し、代表取締役に報告します。
9. 回収処理に関する手順
(1)総括責任者は、製品の品質・安全性に問題があると判断したとき、健康被害に及ぶ製品であることが判明したとき等、製品の回収が必要と判断した場合は危害発生防止等のため、速やかに回収を決定します。また、品質責任者に直ちに回収に着手するよう指示します。
(2)総括責任者は、直ちに製造業者及び出荷先医療機関に対して、回収及び販売の中止を連絡します。この際、未回収品が生じないように製品の出荷記録を精査のうえ、回収数量及び出荷先を特定します。
また、回収を確実に行うため、回収のお知らせ文書を作成し、出荷先にメール及びFAXで送付します。
(3)総括責任者は、上記(2)と並行して、東京都に回収に着手したことを報告します。
<東京都の連絡先>
千代田保健所生活衛生課食品監視指導係
〒102-0074 東京都千代田区九段南1-6-17 千代田会館8階
電話番号:03-5211-8168・8169
ファクス:03-5211-8193
メールアドレス:food-eisei@city.chiyoda.lg.jp
(4)製造販売業者又は総括責任者は、「自主回収届(着手/変更/終了)」を作成し東京都に提出します。
(5)品質管理責任者は、出荷先から送付を受けた製品を確認し、返品された製品の品名、ロット番号及び数量等が在庫管理表と一致しているか確認します。
(6)回収した製品は、原因究明し、措置を決定するまで、誤って出荷されないよう他の製品と区別して適切に保管します。
(7)品質管理責任者は、回収に至った原因を究明し、回収処理結果及び改善措置等について、「自主回収届(着手/変更/終了)」に記載し、総括製造販売責任者に報告します。
(8)回収した製品の措置(廃棄又は返品等の取扱い)は、代表取締役と関係者が協議して決定します。
(9)総括責任者は、回収処理完了後、「自主回収届(着手/変更/終了)」を作成し、東京都に提出します。
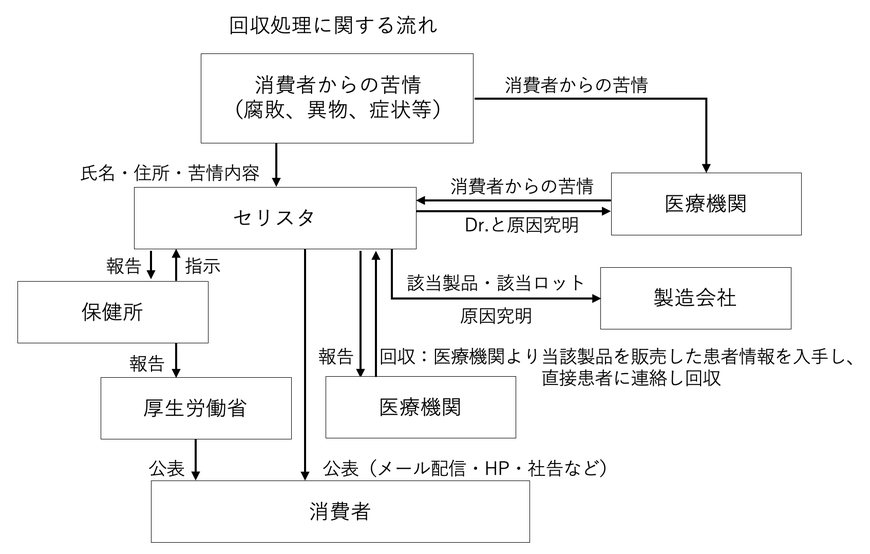
10. 自己点検に関する手順
(1)総括責任者は、毎年3月に「自己点検実施計画書」を作成し、代表取締役の承認を受けます。
(2)品質管理責任者は、毎年3月に自己点検を実施し「自己点検結果報告書」に記載します。
(3)総括責任者は、実施結果を「自己点検結果報告書」にて確認し、要改善の場合には「自己点検改善指示書兼措置記録」の改善指示事項を作成します。
(4)品質管理責任者は改善措置結果を「自己点検改善指示書兼措置記録」に記載し総括責任者へ報告します。
(5)総括責任者は改善措置に対する評価を行い代表取締役に報告します。
11. 情報収集の手順
(1)「収集先一覧表」を元に、学会出展の際に抄録やポスター発表などに取り扱い原料があるかどうかを最優先で確認し情報収集します。(原料の新しい働き、摂取した際の不調や摂取者の健康被害など)
(2)学会での情報収集は主に抗加齢医学会、日本臨床栄養学会総会とします。
(3)学会以外でもPMDAや保健所などのHPで健康食品を摂取した際の人体への影響などの情報収集を行います。
(4)情報収集を行った場合、情報を「安全管理情報の収集記録」並びに「安全性等調査票」に記入の上、総括責任者に提出及び報告します。
12. 教育訓練に関する手順
(1)目的
本手順は、錠剤、カプセル剤等食品の製造管理及び品質管理(GMP)に関する指針(ガイドライン)に基づき、教育訓練を適正かつ円滑に行うために必要な手順を定めるものです。
(2)適用範囲
本手順は品質管理業務および販売に従事する全ての者の教育訓練に関する業務に適用します。
(3)責任者等と役割
①教育訓練に係る責任者は総括責任者もしくは品質管理責任者とします。
②責任者は当該業務の内容を熟知した者であることとします。
③責任者の役割を規定します。
品質管理業務および販売に従事する全ての者に対する教育訓練を計画的に実施し、その記録を作成します。
(4)教育訓練の内容
①製品概論(品質標準書含む)
②品質管理業務手順等
ア)各種手順及び記録
イ)安全管理責任者、その他部門との連携
ウ)製造業者との連携
エ)その他、品質管理業務手順に関連する事項
③その他、教育責任者が必要と認めた事項
(5)教育訓練の種別及び方法
①種別
ア)導入教育
新入社員もしくは人事異動により新たに当業務に携わる時に行う教育です。また、必要に応じて産休等で長期休職し、復職した場合にも適用されます。
イ)定期教育
導入教育後、継続的に行う教育です。以下の場合が想定されます。
・社内で定期的に実施される教育
・定期的に開催される講習会や説明会
ウ)随時教育
必要時に行う教育です。以下の場合が想定されます。
・関係法規の改正等や品質業務手順の改訂に伴い、必要に応じて実施する場合
・新商品などあらたに販売する製品が出た場合
・その他、責任者が必要と認めた場合
②方法
ア)集合教育
社内全体に向けて実施する教育です。品質管理業務手順の改訂や新商品発売等で教育する必要がある場合が想定されます。
イ)個人教育
特定の個人もしくは極めて少人数に対して実施する教育です。人事異動や担当者変更等に伴い実施される場合が想定されます。
ウ)実地教育
手順書等に従い、指導者のもとで実際の業務において体験的に行う教育です。製造所等に対するGMP調査の実地教育、記録書作成における実地教育が想定されます。
エ)社外教育
講習会・説明会・研修会等社外において行う教育です。
(6)記録
教育訓練記録は、作成から5年間は期間保存します。
(7)記録等の様式
教育訓練実施後の記録として「教育訓練記録」を使用して記録、保管します。
13. 文書及び記録の管理に関する手順
(1)文書の制定・改訂・廃止の管理
①関連する文書を作成し、又は改訂したときは、代表取締役による承認を得ます。
②文書の内容を常に適正なものとするため、定期的に見直しを行い、必要があれば改訂を行います。文書の改訂や廃止を行うにあたり、代表取締役はその内容を承認します。
③文書を作成又は改訂したときは、当該文書に日付を記載し、改訂に係る履歴を保存します。
(2)文書及び記録類の保存期間
①文書については使用しなくなった日から5年間保存します。
②記録類については作成の日から5年間保存します。
(3)文書及び記録類の取扱い
①文書及び記録は、総括責任者が業務を行う事務所において正本を保管します。
②記録等を廃棄する際は、個人情報の取り扱いに十分注意した上で適切に行います。
※各管理書式は公開しておりません。
制定・改訂・承認年月日:2024年8月20日
作成・改定者:総括責任者 村田千恵里
承認者:代表取締役 伊藤承正
